
Laboratoire de chimie de la matière condensée de Paris
Tour 44-43 / 4ème étage
Case courrier 174
4, Place Jussieu
75005 PARIS
France
Christophe HELARY
Ingénieur(e) de Recherche
MATBIO
christophe.helary(@-Code a retirer pour éviter le SPAM-)sorbonne-universite.fr

Mon activité de recherche s’articule autour du développement de nouveaux biomatériaux à base de collagène dense pour l’ingénierie tissulaire et la libération contrôlée de biomolécules. Les applications visées sont variées. Tout d’abord, nous développons des hydrogels composites associant le collagène de type I avec des polymères synthétiques biodégradables ou des nanoparticules pour l’élaboration de nouveaux pansements médicamenteux afin de traiter les plaies chroniques de peau. Le but est de libérer de manière contrôlée des principes actifs, des cytokines ou des gènes thérapeutiques afin de promouvoir la cicatrisation. Ma seconde activité est consacrée au développement de modèles 3D in vitro pour l’étude de pathologies et le test de nouvelle molécules pharmacologiques. Nous nous focalisons sur l’élaboration de modèles cardiaques ou mimant la structure du disque intervertébral en suivant une approche biomimétique. Nous visons à synthétiser une matrice servant de support aux cellules qui possèderait les propriétés physiques et biochimiques des matrices extracellulaires naturelles de ces deux organes. Le but final est de recréer l’environnement 3D des cellules et d’étudier leur comportement dans un contexte physiologique.
Projet 1
Nouveaux modèles tridimensionnels pour l’étude des cardiomyopathies dilatées: les hydrogels denses de collagène anisotropes et macroporeux
Les cardiomyopathies dilatées sont des pathologies affectant le cœur et mène à une insuffisance cardiaque chronique. Le seul traitement à long terme est la transplantation cardiaque. Ces maladies sont dans 40% des cas d’origines génétiques et sont souvent des maladies orphelines car plus de 100 mutations génétiques peuvent être à l’origine de cette pathologie. Afin de mieux comprendre cette maladie et de tester des nouvelles molécules pharmacologiques, un modèle cardiaque 3D in vitro est d’un grand intérêt.
Notre stratégie est de synthétiser un biomatériau possédant les propriétés physiques de la matrice extracellulaire du coeur afin d’y cultiver les cellules de patients affectés par les cardiomyopathies dilatées. Notre approche biomimétique est de recréer l’environnement tridimensionnel de la matrice extracellulaire cardiaque physiologique pour analyser le comportement des cellules cardiaques malades. Nous développons un hydrogel dense de collagène macroporeux et anisotrope avec des propriétés mécaniques adéquates en utilisant l’impression 3D de collagène dense (Figure 1A). Notre étude physicochimique a permis de déterminer les conditions de gélification du collagène pour maintenir l’alignement des fibrilles de collagène (l’anisotropie) tout en préservant des propriétés mécaniques importantes. De plus, nous avons mis au point un procédé permettant de générer une macroporosité au sein de l’hydrogel durant l’impression 3D (Figure 1A) ou par ajout d’aiguilles. Le biomatériau ainsi obtenu possède une macroporosité permettant d’ensemencer des cardiomyocytes, les cellules cardiaques et d’introduire un réseau de perfusion afin de maintenir la survie cellulaire (figure XB). Des premiers tests de colonisation cellulaires ont montré que les macropores pouvaient être coloniser par des cellules pour recréer l’organisation 3D des cellules (Figure 1C).
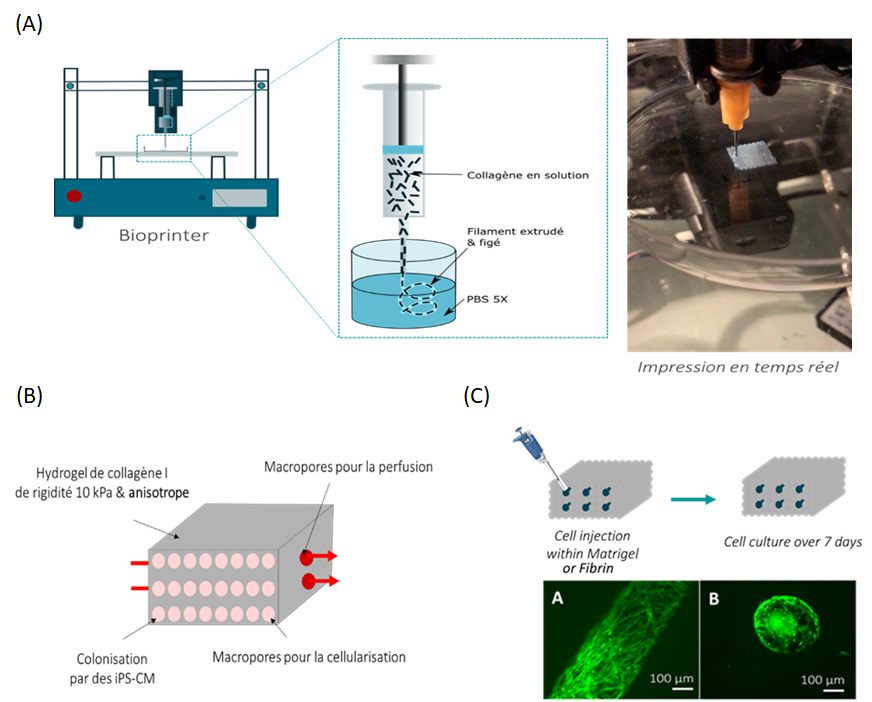
Figure 1: Fabrication d’hydrogels de collagène denses anisotropes comme modèle 3D cardiaque in vitro pour l’étude de cardiomyopathies dilatés. (A) L’hydrogel servant de support aux cellules cardiques est réalisé par impression 3D. (B) L’hydrogel ainsi obtenu doit être anisotrope, avoir une rigidité de 10 kPa et être macroporeux pour permettre la culture de celluels. (C) Injection de fibroblastes dans les macropores pour la colonisation de l’hydrogel.
Projet 2
Hydrogels composites denses collagène/polyester pour la libération contrôlée de médicaments : un nouveau pansement médicamenteux pour le traitement des plaies chroniques de peau.
Les plaies chroniques de peau sont une conséquence d’un diabète non équilibré qui se produit chez 15% des patients. Les traitements habituels basés sur la compression de la blessure ou l’application de gels d’alginate peut s’avérer insuffisante pour guérir ces plaies. Ainsi un nouveau pansement médicamenteux qui permettrait d’accélérer la cicatrisation de la peau est d’un grand intérêt. Les hydrogels de collagène sont des candidats prometteurs car ils possèdent des propriétés cicatrisantes.
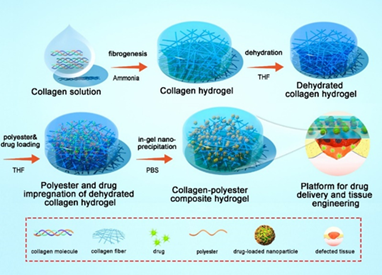
Figure 2 : Procédé de fabrication des hydrogels composites denses collagène/polyester basé sur la précipitaion in situ de polymères et de drogues pharmacologiques. (Wang X et al, Advanced Science 2021 ; 8 (7), 2004213)
Nous avons développé un procédé original permettant la synthèse d’hydrogels composites denses associant du collagène de type 1 et un système de délivrance de médicaments. Notre stratégie repose sur la précipitation in situ de polyesters et de molécules pharmacologiques dans le réseau de collagène 1 (Figure 2). Il s’agit de former un gel dense de collagène par remontée de pH, puis de le déshydrater avec du tétrahydrofurane et de l’imprégner avec un mélange de polyesters et de molécules pharmacologiques. En le plongeant dans un non solvant tel que le PBS, la précipitaion de particules de polyesters encapsulant les médicaments est réalisée. Cette technique permet d’immobiliser dans l’hydrogel une grande quantité de polyesters et de médicaments ce qui va permettre la libération contrôlée de la molécules active. Plusieurs types de polyesters ont été testés (Figure YA). Les hydrogels composites formés avec du PLGA à 7 kDa (PLGA 1) ont des propriétés mécaniques améliorées (Figure YC) et une structure fibrillaire dans laquelle des particules de PLGA ont précipité (Figure YB). La libération de spironolactone, un médicament favorisant la cicatrisation, est prolongée et constante sur environ un mois (courbe rose – Figure 3D). Un test in vivo chez la souris a été effectué. Des hydrogels composites avient un effet cicatrisant sur des blessures cutanées de peau en accélrant la fermeture et en promouvant la formation d’un nouvel épiderme (Figure 4).
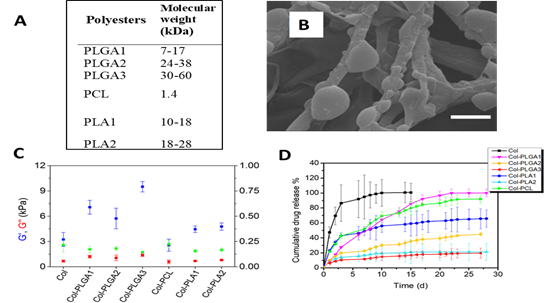
Figure 3 : Propriétés des hydrogels composites denses : (A) : Types de polyesters utilisés pour la nanoprécipitation. (B) Structure des hydrogels observés par microscopie à balayage. Des particules de polymères ont précipité à la surface des fibrilles de collagènes.(C) Propriéts mécaniques des hydrogels en fonction du polyester utilisé. (D) Profil de libération du médicament spironolactone sur un mois

Figure 4 : Effet cicatrisant de la spironolactone libéré à partir des hydrogels composites denses collagène/PLGA 7kDa. Les hydrogels accélèrent la fermeture de la blessure et la réépithélialisation.
Projet 3
Hydrogels composites collagène/acide hyaluronique injectables pour la régénération du disque intervertébral
Les maux de dos sont considérés comme le mal du siècle avec une prévalence qui augmente avec le vieillissement de la population. Dans la moitié des cas, les pathologies dorsales sont liées à la dégénérescence des disques intervertébraux. Ces derniers sont situés entre chaque vertèbre de la colonne et jouent un rôle important dans la mobilité du tronc. Le Nucleus Pulposus (NP) situé au centre est d’aspect gélatineux et joue le rôle d’amortissuer hydraulique. Il est entouré par l’Anulus Fibrosus (AF), tissus fibreux permettant de contenir les pressions exercées sur le Nucleus Pulposus (Figure 5). Dans le cas de dégénérescence, le NP se déshydrate et peut fuir en fissurant l’AF créant une hernie discale (Figure 5).
Hydrogels composites collagène/acide hyaluronique injectables pour la régénération du disque intervertébral

Figure 5 : Structure du disque intervertébral et traitements de la dégénéresence. Les injections d’hydrogels permettent le rétablissement de la hauteur du disque et de son dégré d’hydratation. Les patchs permettent de fermer les fissures de l’AF et d’empêcher les fuites du NP hors du disque
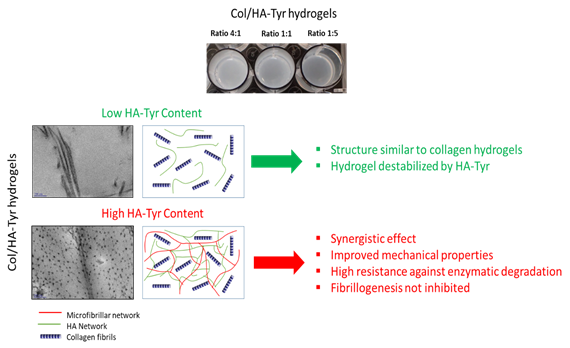
Notre stratégie biomimétique a pour but de développer un hydrogel composite composé de collagène de type 1 et d’acide hyaluronique afin de reproduire les propriétés biochimiques, physiques et biomécanique du Nucleus Pulposus. En injectant cet hydrogel, il serait possible de restaurer les propriétés du NP et d’y encapsuler des cellules souches qui pourraient promouvroir la régénération du disque intervertébral. D’autre part, ce biomatériau pourrait être utiliser comme modèle de NP pour comprendre les premières étapes de la dégénérescence. A l’aide d’une étude physico-chimique, nous avons analysé les interactions entre les deux biopolymères et mis au point une formulation adéquate permettant de mimer le NP (Figure 6). En utilisant un ratio collagène/acide hyaluronique de 1 :5, nous avons reproduit les propriétés mécaniques et l’hydratation du NP. De plus sa composition biochimique et son ultrastructure ressemblent à celles observées in vivo. Enfin, il est possible d’encapsuler des cellules souches mésenchymateuses dans des biomatériaux sans affecter leur viabilité.
Ce programme de recherche est par ailleurs financé par l’ANR pour la réalisation d’un modèle de disque intervertébral pour l’étude de la dégénérescence et le test de molécules pharmacologique. (Projet INDEED, ANR-19-CE06-0028)
Collaborations:
- Collaborations Nationales
- Biologie, Bioingénierie et Bioimagerie Ostéoarticulaires (B3OA) – Hôpital Lariboisière – Paris – Dr Esther Potier
- Regenerative Medicine and Skeleton (RMes) – Inserm UMRS 1229 – Université de Nantes –Nantes – Dr Jérome Guicheux et Dr Catherine Levisage Institut de Biologie Paris Seine – Adaptation biologique et vieillissement (B2A) – UMR 8256 -Equipe Cellules Souches et Biothérapies (Carther) – Sorbonne Université – Paris – Dr Onnik Agbulut et Dr Pierre Joanne
- Institut des Nanoscience de Paris (INSP) – Sorbonne Université – Paris – Pr Tristan Baumberger et Dr Olivier Ronsin –
- 2) Collaborations internationales
- AO Foundation Research Institute (ARI) – Team Regenerative Orthopaedics – Davos, Suisse – Dr Matteo D’Este
- Institute for Biomechanics – Ecole Polytechnique de Zurich (ETH) – Zurich, Suisse – Pr Stephen Ferguson
- Macau University of Science and Technology – Macao, Chine – Dr Xiaolin Wang
- Faculté de Pharmacie et de Biochimie – Université de Buenos Aires – Buenos Aires, Argentine – Pr Martin Desimone
